Un peu d’histoire
Les bêtabloquants (BB) occupent une place classique et historique dans la prise en charge de l’infarctus du myocarde (IDM). J’en veux pour preuve le célèbre traitement BASIC post-infarctus que nombre d’entre nous a appris au cours de leurs études (Bêtabloquant, Aspirine, Statine, IEC, Clopidogrel). Le rationnel est que les BB diminuent la demande myocardique en oxygène par leur effet inotrope et chronotrope négatif, et augmentent le temps de diastole et donc la perfusion coronaire, diminuant ainsi l’ischémie et les risques de troubles du rythme ventriculaire.
Le bénéfice des BB dans l’IDM a été démontré pour la première fois dans l’essai BHAT (Beta-Blocker Heart Attack Trial) (avec le propranolol), dès 1982. Dans une méta-analyse publiée en 1999 et portant sur plus 50.000 patients et 82 essais randomisés, la prescription de BB permettait une baisse relative significative de la mortalité totale de 23% dans les deux ans suivant l’IDM, alors que le bénéfice à court terme n’était pas démontré. Les auteurs s’interrogeaient déjà sur la place des BB avec l’arrivée de la revascularisation par thrombolyse, et soulignaient leur place centrale future en cas de fraction d’éjection ventriculaire gauche (FEVG) altérée après IDM (le carvedilol avait démontré son efficacité dans l’insuffisance cardiaque (IC) à FEVG altérée en 1996 et CIBIS-II était publiée en janvier 1999).
Dans les années qui suivirent, l’essai CAPRICORN (2001) montrait, sur 1800 patients, que l’adjonction d’un traitement par carvedilol en cas de FEVG inférieure à 40% (FEVG moyenne 32%) après un IDM (revascularisation par thrombolyse dans 45% des cas) permettait un baisse relative de la mortalité toute cause de 23% à 2,5 ans (p=0,03). Sauf que la mortalité totale est… un critère secondaire. Le critère primaire (mortalité totale ou hospitalisation pour causes cardiovasculaires) n’est pas différent dans les deux groupes (35% vs 37% ; HR 0,92 ; IC95% 0,80-1,07). Et le plan d’analyse statistique fixait une significativité pour le critère de mortalité à p=0,005 ; autant dire qu’on en est loin. L’essai COMMIT (2005), essai randomisé en double aveugle comparant le succinate de metoprolol (injection intraveineuse puis relai per os) à un placebo, faisait lui aussi chou blanc après un suivi de 4 semaines malgré l’inclusion de 45.000 patients (!) dont 54% avec une thrombolyse. Un quart des patients avait des signes congestifs (classe killip 2 ou 3) (la FEVG n’est pas disponible). L’analyse en détail de l’essai que proposait S. Kaul dans un éditorial récent permet de rappeler que le traitement par metoprolol évitait 5 IDM et 5 arythmies ventriculaires pour 1000 patients, au prix de 11 chocs cardiogéniques de plus.
Ces études ont été menées à une époque antérieure à l’avènement des prises en charge modernes de l’IDM, que ce soit au plan thérapeutique (reperfusion coronaire percutanée, double anti-agrégation plaquettaire, statines) ou diagnostique (dosage des troponines de haute sensibilité). Les progrès thérapeutiques des dernières décennies ont radicalement transformé le pronostic des patients. La proportion de masse myocardique nécrosée, et donc exposant au développement d’arythmie ventriculaire et/ou d’altération de la FEVG, est désormais bien moindre que dans les années 90 ou même les années 2000. En 2014, une méta-analyse de 60 essais randomisés et 100.000 patients remettait le dogme en question en concluant que les BB, dans le cadre de la prise en charge moderne de l’IDM, ne réduisaient pas la mortalité mais diminuait les récidive d’IDM, au prix d’une augmentation du risque d’IC ou de choc cardiogénique. Une méta-analyse de la Cochrane publiée en 2021, portant sur les patients sans IC post IDM, était également très prudente, soulignant les faiblesses méthodologiques de nombre des études publiées à date.
Il y a eu évidemment une myriade d’études observationnelles, au cours des deux décennies écoulées, pour tenter de préciser la place des BB à l’ère moderne de la prise en charge de l’IDM, toutes sujettes aux biais habituels de ce genre d’analyse ; mais qui suggéraient néanmoins que le bénéfice n’était pas forcément si important qu’on aurait pu le penser (le fait est que si une étude observationnelle ne montre pas de différence entre deux prises en charge, il y a peu de chance qu’un essai randomisé le fasse – l’inverse n’étant pas vrai). Je m’abstiendrai de la recension de cette littérature sans grand intérêt désormais. Si l’utilité des BB ne fait pas de doute chez les patients présentant une FEVG inférieure à 40% au décours de l’épisode aigu, pas tant du fait des résultats de CAPRICORN, mais parce qu’ils sont un des piliers du traitements l’IC à FEVG altérée, la question se pose dans les autres cas. Elle est d’ailleurs tellement pressante que plusieurs essais randomisés ont été publiés au cours des derniers mois, et en particulier deux lors du congrès de l’ESC 2025 qui s’est tenu à Madrid.
Les essais randomisés modernes
CAPITAL RCT
Bien avant le retour du sujet sur le devant de la scène à la faveur des études dont nous allons parler plus loin, la place des BB dans la prise en charge moderne de l’IDM avait été explorée dans l’étude CAPITAL-RCT (Carvedilol Post-Intervention Long-Term Administration in Large-scale Randomized Controlled Trial) publiée en 2018. Dans cette étude randomisée multicentrique en ouvert réalisée au Japon, les patients ayant bénéficié d’une angioplastie coronaire dans le cadre d’un IDM avec sus-décalage du segment ST et avec une FEVG supérieure à 40%, ont été randomisés entre traitement par carvedilol ou pas de traitement.
Le critère primaire était initialement la mortalité toute cause avec l’objectif de randomiser 7.600 patients, mais le protocole a dû être amendé en raison d’un recrutement trop lent, l’objectif étant ramené à 1.300 patients et le nouveau critère primaire élargi (décès toute cause, IDM, hospitalisation pour syndrome coronaire aigu et hospitalisation pour IC). Finalement, 801 patients seulement seront inclus et randomisés, et suivi pendant une durée médiane de 3,9 ans. Il n’y a pas de différence sur le critère primaire (carvedilol 6,8% vs contrôle 7,9% ; HR 0,75 ; IC95% 0,47-1,16 ; p=0,20). L’essai manque trop de puissance par rapport à ses ambitions pour permettre d’en tirer des conclusions. C’est un problème souvent observé pour les essais qui veulent confirmer ou infirmer un dogme établi de longue date : médecins (et patients) rechignent à participer à un essai où il y a une chance sur deux de faire partie du groupe qui serait privé d’un traitement considéré (à tort ou à raison) comme indispensable (un problème déjà discuté ici notamment).
Les auteurs ont commis en 2023 une étude post-hoc analysant l’effet du carvedilol selon la FEVG initiale (inférieure ou supérieure à 55%). La faiblesse méthodologique d’une telle analyse pour une étude manquant déjà de puissance à la base nous évitera d’avoir à la lire plus avant.
REDUCE-AMI

REDUCE-AMI (Randomized Evaluation of Decreased Usage of Beta-Blockers after Acute Myocardial Infarction), publiée dans le NEJM en 2024, est un essai institutionnel, en ouvert, basé sur les données de registre, conduit majoritairement en Suède. 5.020 patients (âge médian 65 ans, 78 % d’hommes) ayant présenté un IDM (avec sus-décalage du segment ST dans 35% des cas, atteinte multitronculaire dans 45% des cas) dans la semaine précédente et ayant une FEVG supérieure à 50% ont été randomisés entre traitement BB et bras contrôle. Le BB devait préférentiellement être du metoprolol, mais le bisoprolol était une alternative autorisée.
Le protocole a été amendé car le taux d’évènement dans le bras contrôle était inférieur aux anticipation (7% annuel anticipé et 3 % observé), et alors dimensionné pour détecter une baisse relative des évènements de 25% dans le groupe BB sur la base de 380 évènements. Après un suivi médian de 3,5 ans, le critère primaire (décès toute cause et récidive d’IDM) survient chez 199 patients (7,9% ; taux d’évènement annuel 2,4%) dans le groupe BB, et chez 208 patients (8,3% ; taux d’évènement annuel 2,5%) dans le groupe contrôle (HR 0,96 ; IC95% 0,79-1,16 ; p=0,64). L’ensemble des critères secondaires survient de manière équivalent dans les deux groupes. A un an, 18% des patients du groupe BB ne prend plus le traitement, et 14% du groupe contrôle est traité par BB, ce qui est assez élevé et inévitable dans un essai en ouvert, et tend à favoriser le résultat nul.
Le taux d’évènement observé est conforme aux anticipations du protocole amendé, et l’intervalle de confiance exclu bien la baisse de 25% prévue dans le plan statistique. Cependant, l’essai est sous dimensionné pour la baisse de 17% envisagée initialement. Il aurait été plus pertinent (mais aussi plus onéreux) d’augmenter le nombre de patients inclus, plutôt que d’envisager à la hausse une baisse très optimiste – d’aucun dirait irréaliste – des évènements. Cependant, la superposition des courbes de survie et la cohérence des résultats des critères secondaires laissent à penser qu’un effet cliniquement pertinent des BB est hautement improbable dans cette étude.
REBOOT
L’essai REBOOT (Treatment with Beta-Blockers after Myocardial Infarction without Reduced Ejection Fraction) est un essai randomisé institutionnel, mené en Espagne et en Italie. L’essai était mené en ouvert avec adjudication des évènements en aveugle (design PROBE). 8.505 patients ont été inclus (moyenne d’âge 61 ans, 81% d’hommes), ayant présenté un IDM avec (51%) ou sans (49%) sus-décalage du segment ST. La FEVG devait être supérieure à 40% au moment de la sortie de l’hôpital ; 11% des patients avait une FEVG entre 40 et 50% et la FEVG moyenne est de 57%. Les patients ne pouvaient pas être inclus en cas d’épisode congestif à la phase aiguë. 92% des patients a bénéficié d’une revascularisation coronaire par angioplastie ; un quart des patients présentait des lésions multitronculaires. Le traitement BB n’était pas protocolisé, molécule et dose étant laissées aux choix des cliniciens. Le bisoprolol a été utilisé dans l’immense majorité des cas (86% des cas ; metoprolol 7,5%, carvedilol 3%, nebivolol 3 %). Le taux de changement de groupe est aussi important que dans REDUCE-AMI : à 15 mois, 18% des patients du groupe BB n’est plus sous traitement, et 18% des patients du groupe contrôle est traité par BB.

Après un suivi médian de 3,7 ans, le critère de jugement primaire (décès toutes causes, récidive d’IDM et hospitalisation pour IC) survient chez 316 patients (22,5 évènements pour 1000 patient-années) dans le groupe BB et chez 307 patients (21,7 évènements pour 1000 patient-années) dans le groupe contrôle (HR 1,04 ; IC95% 0,89-1,22 ; p=0,63). Il n’y a pas de différence quand on analyse les éléments du critère primaire pris individuellement, ni dans les critères secondaires, tertiaires ou de sécurité. L’essai a dû être prolongé en raison d’un taux d’évènement inférieur aux prédictions du protocole statistique ; et si le nombre total de patient prévu a bien été atteint, le nombre d’événement est inférieur de 15% à ce qui était prévu. Néanmoins, l’intervalle de confiance du critère primaire exclu la baisse de 20% spécifiée au protocole, et compte tenu de la superposition des courbes et de la cohérence des résultats pour les critères secondaires ou tertiaires, il est improbable que ce manque de puissance remette en question les résultats. Il y a évidemment une analyse de sous-groupe qui suggérerait que les patients présentant un IDM sans sus -décalage du segment ST ou de sexe masculin pourraient bénéficier du traitement plus que les autres, mais il manque malheureusement l’analyse par signe astrologique pour être complet…
BETAMI-DANBLOCK
Cette publication est en fait la fusion de deux essais : BETAMI (Norwegian Beta-Blocker Treatment after Acute Myocardial Infarction in Revascularized Patients without Reduced Left Ventricular Ejection Fraction) conduit en Norvège, et DANBLOCK (Danish Trial of Beta-Blocker Therapy after Myocardial Infarction without Heart Failure) réalisé au Danemark. Les deux essais initialement indépendants ont été fusionnés en raison des difficultés d’inclusion liées à la Pandémie, leur protocole – et notamment critères d’inclusion – étant jugés suffisamment proche. Cependant le critère de jugement a dû être harmonisé et élargi, et les deux essais divergent toute de même sur certains points.
| BETAMI | DANBLOCK |
|---|---|
| IDM de type 1 seulement | IDM de type 1 et 2 |
| FEVG d’au moins 40% | FEVG strictement supérieure à 40% |
| Revascularisation coronaire obligatoire | Pas de critère spécifique |
| Randomisation dans les 7 jours suivant l’IDM | Randomisation dans les 14 jours suivant l’IDM |
| Critère primaire : Mortalité toutes causes ou IDM non fatal | Critère primaire : Mortalité toutes causes, nouvel IDM, angor instable, accident vasculaire cérébral ou IC |
5.622 patients (âge médian 63 ans, 20% de femmes) ont été inclus dans cet essai randomisé institutionnel, là encore utilisant un protocole PROBE. 47,5% des patients ont présenté un IDM avec sus-décalage du segment ST, et 94% a bénéficié d’une revascularisation coronaire. Comme dans REBOOT, le suivi n’a pas été fait par des visites dédiées, mais par l’interrogation des bases de données médicales et des services de santé. Là encore, la molécule et la dose de BB était laissées au choix des cliniciens ; le metoprolol est le BB le plus prescrit (94% ; dose médiane 50 mg). A 6 mois, 12% des patients a changé de groupe (je n’ai pas trouvé l’information à un an).

Le critère composite primaire (décès toutes causes et évènements cardiovasculaires majeurs – IDM, revascularisation coronaire urgente, AVC ischémique, insuffisance cardiaque ou arythmie ventriculaire grave) est plus large que dans les autres études. Après un suivi moyen de 3,5 ans, il survient chez 394 des 2783 patients (14,2%) du groupe BB et chez 454 des 2791 patients (16,3%) du groupe contrôle (HR 0,85 ; IC95% 0,75-0,98 ; p=0,03). Ce résultat est tiré par l’excès d’IDM dans le groupe contrôle (5,0% vs 6,7% ; HR 0,73 ; IC95% 0,59-0,92), alors que les autres éléments du critère primaire ne diffèrent pas, notamment décès toutes causes (4,2 vs 4,4 %) et revascularisation urgentes (3,9% vs 3,9%).
Les analyses de sous-groupes vont à l’opposé des celles de REBOOT, puisqu’ici les femmes et les patients avec un infarctus avec sus-décalage du segment ST bénéficient cette fois ci plus du traitement bétabloquant… Mais on continue à publier de telles analyses.
ABYSS
Contrairement aux autres études qui analysent la place de l’ajout des BB à la phase aiguë de l’IDM, ABYSS (Assessment of Beta-Blocker Interruption 1 Year after an Uncomplicated Myocardial Infarction on Safety and Symptomatic Cardiac Events Requiring Hospitalization), étude française publiée en 2024 dans le NEJM, se penche sur la question de l’arrêt du traitement à distance de l’IDM. Il s’agit d’une étude randomisée de non-infériorité, menée selon un design PROBE, incluant des patients traités par BB (quelles que soient la molécule et la dose) après un IDM survenu au moins 6 mois plus tôt, et ayant une FEVG supérieure à 50% (et aucune autre indication à un traitement BB, évidement). Ne pouvaient être inclus les patients ayant présenté un épisode d’IC et/ou une FEVG inférieure à 40%, les patients avec une ischémie et/ou un angor persistant et ceux ayant présenté un épisode de trouble du rythme ventriculaire ou supraventriculaire dans l’année écoulée

3700 patients ont été prévu, avec une borne supérieure de non-infériorité fixée à 3% de différence absolue et un taux d’évènement dans le groupe contrôle de 12%, soit une borne supérieure de risque relatif de 25% (pourquoi c’est important quand on analyse une étude de non infériorité ?). Au final, 3.698 patients (âge moyen 63,5 ans, 17% de femmes) ont été randomisés, 2,9 ans (médiane) après l’IDM. La majorité des patients (72%) était traitée par bisoprolol (acebutolol 11%, atenolol 9%, nebivolol 6%, metoprolol 1%), à des doses moyennes assez faibles (bisoprolol 3,4 mg, acebutolol 195 mg, atenolol 54 mg, nebivolol 4,4 mg, metoprolol 85 mg) Le taux de crossover est assez faible (5,7%), et surtout le fait des patients remis sous traitement après leur randomisation dans le groupe « arrêt » (8,6%), alors que moins de 3% des patients du groupe « poursuite du traitement » ont arrêté le traitement. Après un suivi médian de 3 ans, le critère de jugement primaire (décès, IDM non fatal, AVC non fatal et hospitalisation pour cause cardiovasculaire) survient chez 432 patients (23.8%) dans le groupe interruption et 384 (21.1%) dans le groupe poursuite du traitement (HR 1,16 ; IC95% 1,01-1,33 ; p=0.44 pour la non-infériorité). L’arrêt du traitement BB ne serait donc pas non inférieur à la poursuite du traitement, et l’intervalle de confiance laisse à penser que la poursuite serait même supérieure à l’arrêt du traitement ; dit autrement il ne faudrait pas arrêter les BB, même trois ans après un IDM.
Dans une analyse publiée au début de l’été, les auteurs montrent que l’arrêt du traitement BB est associé à une augmentation plus importante de la fréquence cardiaque et de la pression artérielle que dans le groupe qui a continué le traitement. Cette élévation n’est pas totalement compensée au cours du temps, de sorte que les patients chez qui le traitement a été interrompu ont une pression artérielle 3 mmHg plus élevée en fin d’étude. Il faut cependant rappeler que l’absence d’aveugle entraîne des biais dans la retranscription de la pression artérielle, et que le résultat d’ABYSS ne semble pas majoritairement tiré par les ischémies myocardiques (j’y reviens plus loin). Le papier a néanmoins le mérite de rappeler que l’arrêt d’un traitement BB doit être compensé par l’adaptation du traitement antihypertenseur afin de maintenir une pression artérielle à l’objectif.
Quelques commentaires et réflexions
Le premier enseignement est que le traitement BB (initiation ou arrêt), n’influe ni sur la mortalité totale, ni sur la mortalité cardiovasculaire, ni sur le risque de trouble du rythme ventriculaire, de revascularisation ou d’IC. La mortalité totale dans chacun des essais est de 3 à 4% sur la durée de l’étude. En 1982, dans l’étude BHAT, la mortalité totale du groupe BB était de 7,2% à 2 ans, et 9,8% dans le groupe placebo. Dans le registre FAST-MI, la mortalité à 6 mois de l’IDM avec sus-décalage du segment ST est passée de 17% en 1995 à 5,3% en 2015. On voit donc les bénéfices majeurs liés à la prise en charge moderne de l’IDM. Or, plus le risque diminue et plus il est difficile de démontrer un bénéfice au traitement, à moins d’une inflation de la population étudiée, si tant est qu’un bénéfice existe.
On observe en outre que la mortalité cardiovasculaire ne représente qu’un tiers environ de la mortalité totale. Cette proportion est retrouvée dans les études observationnelles. Outre que c’est un argument de validité externe des études (les patients inclus et les prises en charge sont représentatifs de la « vraie vie »), c’est une autre explication à l’absence de bénéfice des BB sur la mortalité. Étant donné le taux faible de décès d’origine cardiaque chez les patients présentant un IDM non compliqué, il est peu probable que les BB permettent une réduction de la mortalité totale.
En plus d’un traitement médical agressif (statine, double anti-agrégation), l’immense majorité des patients bénéficie d’une revascularisation coronaire en phase aiguë, permettant une meilleure récupération myocardique, une meilleure oxygénation myocardique et une incidence plus faible des dysfonction ventriculaire gauche ou des arythmies ventriculaires, mécanismes sur lesquels les BB exercent un effet protecteur. L’absence d’augmentation des revascularisations coronaires dans le groupe contrôle, illustre l’efficacité de la prise en charge initiale et de la revascularisation coronaire.
Le cas des infarctus du myocarde
La seule différence entre les études se trouve pour le risque de survenu dess IDM, plus fréquents dans le groupe contrôle quand dans le groupe BB dans la seule étude BETAMI-DANBLOCK.
Si tous les essais visent à clarifier le rôle des BB après un IDM avec une FEVG non altérée, ils diffèrent par la précision de leurs fenêtres de randomisation (avant 7 jours pour BETAMI et REDUCE-AMI, avant 14 jours pour les autres), l’exigence ou non d’une revascularisation comme critère d’inclusion (la revascularisation n’était un critère d’inclusion clairement mentionné que dans BETAMI), et la spécificité de leur approche en matière de FEVG (> 50% pour REDUCE-AMI, > 40% pour REBOOT, CAPITAL-RCT et DANBLOCK, supérieure ou égale à 40% pour BETAMI). Néanmoins, les caractéristiques des patients inclus dans les différents essais sont assez proches (voir tableau) de sorte que ces éléments ne semblent pas prépondérants pour expliquer la différence entre BETAMI-DANBLOCK d’une part, et les autres essais d’autre part. De même, la définition de l’IDM comme critère de jugement diverge entre les études (3ème définition pour REBOOT, 4ème définition pour les autres ; tout type d’IDM dans REDUCE-AMI, seulement les IDM de type 1 et 2 dans les autres études), mais il n’est pas certain que ces différences constituent une explication aux différences de résultats.
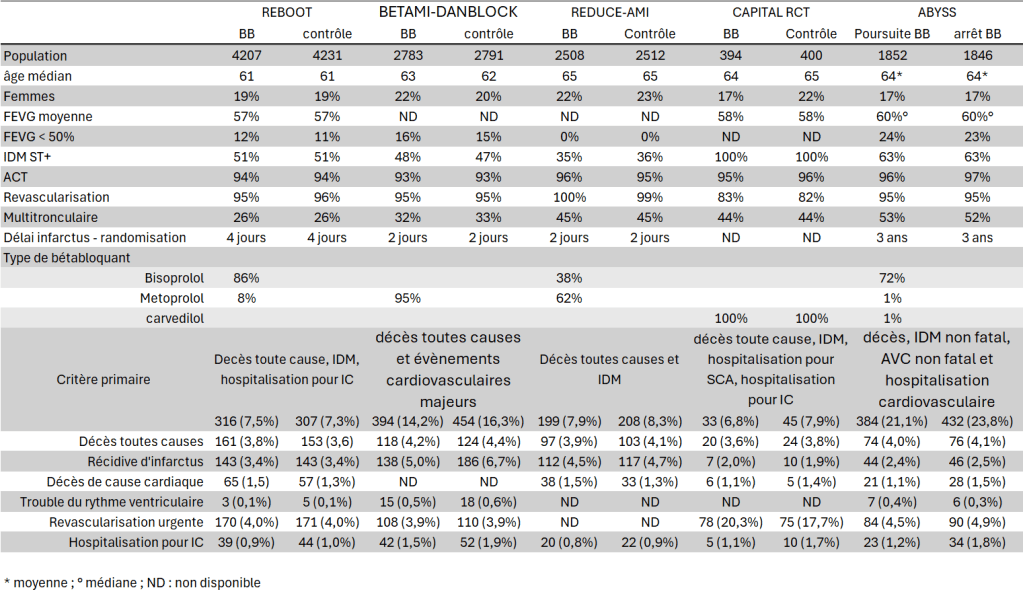
La différence participe-t-elle des différences de traitement BB ? Les doses ne sont pas très élevées, ce qui contraste avec les doses administrées dans l’IC. Néanmoins, dans aucune des études n’apparaît de corrélation entre dose administrée et (absence de) bénéfice clinique. En outre, dans l’IDM, les hautes dose de BB ne font pas forcément mieux que des doses plus faibles. Autre possibilité, que le BB utilisé soit aussi important dans le post IDM que dans l’IC. Il n’y a pas d’effet classe (tous les BB ne se valent pas) dans l’IC à FEVG altérée : le bucindolol, par exemple, a échoué à démontrer un intérêt dans l’étude BEST. Dans BETAMI-DANBLOCK, le succinate de metoprolol est utilisé dans 95% des cas. Je souligne, car on parle bien de succinate (SELOZOK®) et non pas de tartrate (SELOKEN®) de metoprolol ; la différence existe également dans la prise en charge de l’IC (MERIT-HF vs COMET). Néanmoins le succinate de metoprolol a également été pris par deux tiers des patients de REDUCE-AMI, sans baisse des IDM
Dans BETAMI-DANBLOCK, 35% des infarctus (soit environ 115 évènements) surviennent chez des patients n’ayant pas eu de revascularisation à la phase aiguë. Or on peut estimer à 280 le nombre de patients sans revascularisation à la phase aiguë (5% de la population totale de l’essai). Ce qui ferai que 41% des patients non revascularisés aurait présenté un IDM et seulement 4% des patients revascularisés (en supposant qu’il n’y a pas plus d’un évènement par patient). En l’absence d’information du même type dans les autres études, difficile d’avancer une explication définitive. Surtout qu’il n’y pas moins de revascularisation dans BETAMI-DANBLOCK que dans REBOOT ou REDUCE-AMI.
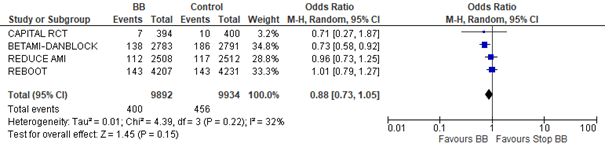
Enfin, il est toujours possible que ce résultat soit un aléa statistique. Surtout que BETAMI-DANBLOCK n’est pas un essai homogène, mais le fusion de deux essais, avec des critères d’inclusion et de jugement, et des plans d’analyse statistique, différents. Si on fait une analyse groupée de l’ensemble des études, il n’y a pas de différence significative de survenue des IDM. Cette absence de significativité persiste même en excluant REDUCE-AMI, qui diffère des autres études en ce qu’elle n’a inclus que de patients ayant une FEVG supérieure à 50%.
FEVG inférieure à 50%
Directement dans les suites des présentations de BETAMI-DANBLOCK et REBOOT à l’ESC, a été présentée une méta-analyse sur données individuelles simultanément publiée dans le Lancet, étudiant l’effet de l’arrêt des BB dans la population des patients ayant une FEVG entre 40 et 50%, issue des essais randomisés dont nous venons de parler. Je précise d’emblée qu’un épisode de congestion au cours de l’hospitalisation était un critère d’exclusion de toutes les études.

Les auteurs identifient 1.885 patients (âge médian 63 ans, 19% de femmes, 32% d’IDM avec sus-décalage du segment ST, FEVG médiane 45%), soit 13% de la population totale des essais REBOOT, BETAMI-DANBLOCK et CAPITAL-RCT. REDUCE-AMI n’a évidement pas été pris en compte puisque les critères d’inclusions spécifiaient que la FEVG devait être supérieure à 50%. Le metoprolol est utilisé dans 49% des cas, le bisoprolol dans 44% des cas. Le suivi médian est de 3,5 ans. Le critère primaire (décès toutes causes, IDM ou IC) survient chez 106 patients (11%) (32,6 évènements pour 1000 patient-années) dans le groupe BB et chez 129 patients (14%) (43,0 pour 1000 patient-années) dans le groupe contrôle (HR 0,75 ; IC95% 0,58–0,97 ; p=0,031). Les différents composants du critère primaire ne sont pas significativement différents entre les groupes, notamment les IDM, mais on arrive sur un nombre limité d’évènements et l’analyse manque clairement de puissance pour être pertinente. C’est encore plus vrai pour les décès de cause CV pour lesquels la population étudiée ne représente qu’à peine 10% de l’effectif total des essais, en raison de l’absence d’information sur les causes de décès dans BETAMI.
Une limite majeure de cette analyse, relevée par les auteurs, est qu’on parle ici d’essais « pragmatiques », dont les données sont colligées à partir de données de vie réelle. Et notamment la mesure de FEVG en échographie cardiaque. Les valeurs de FEVG sont issues d’examens réalisés en soins intensifs, en urgence, loin d’une belle salle avec un échographe dernier cri et 30 minutes de temps devant soit. Tout personne ayant fait des gardes d’USIC et/ou géré des patients en urgence sait que la détermination de la FEVG n’est pas toujours faite dans les règles de l’art. Un patient avec une FEVG de 35-40% peut être affublé d’un 40% et être inclus dans BETAMI, un patient avec 48 % être mesuré à 50% ou 55% et être exclu de cette analyse, un patient avec 50% se voir coter une FEVG à 45% – et être inclus dans cette analyse – parce que ça colle mieux visuellement, etc. Est-ce un hasard si la valeur médiane de la FEVG de ce groupe est justement 45% ? Que pensez-vous qu’on inscrive sur un compte rendu devant une FEVG pas tout à fait normale sans être vraiment altérée ?
Arrêt du traitement à distance de l’infarctus
Regardons en détail les résultats les résultats d’ABYSS. Certes le critère primaire n’atteint pas la non-infériorité. Mais il n’y pas de différence de décès (4,1% vs 4,0%), d’IDM (2,5% vs 2,4%) ou d’AVC (1,0% vs 1,0%). Les hospitalisations pour cause cardiovasculaire sont en revanche plus fréquentes (18,9 vs 16,6%) en cas d’arrêt du traitement. Comme les patients ne sont pas hospitalisés pour IDM, serait-ce à cause d’un surcroît de trouble du rythme ventriculaire ou de poussée d’IC ? pas du tout. L’excès d’hospitalisation est lié à des « raisons coronaires » (tableau 2) et au premier rang desquelles les angiographies (7,9% vs 6,3%) sans revascularisation (4,9% vs 4,5%).
Ce résultat est explicable dans un essai en ouvert (et l’adjudication en aveugle des évènements n’y changera rien) : une douleur thoracique plus ou moins typique ne sera pas explorée de la même façon chez un patient sous BB et chez un patient chez qui le traitement a été arrêté, de même que le patient ne réagira pas de la même façon s’il est sous traitement ou si le traitement pris depuis des années a été arrêté (sans compter l’effet de phrases telles que « au moindre doute vous nous prévenez »). Après des années de traitement par BB, l’apparition d’un symptôme potentiellement coronaire est source d’angoisse pour le patient et le praticien ; l’exploration coronaire permet de lever cette angoisse, et l’absence de sténose coronaire significative permet par elle même de rassurer le patient et améliorer les symptômes.
Au soutien de cette lecture, on retrouve d’une part l’absence de différence entre les groupes si les hospitalisations cardiovasculaires ne sont pas incluses dans le critère composite (table 2), et d’autre part l’analyse perprotocle (table S6). Quand les patients sont répartis selon qu’ils prennent ou pas un BB (et non pas selon le groupe dans lequel ils devraient être), la différence est moins évidente, que ce soit pour le critère primaire (22,2% dans le groupe interruption et 21,1% dans le groupe poursuite du traitement) ou pour les hospitalisations pour raisons cardiovasculaires moins divergentes (17,9% vs 16,9%).
12% de la population de REBOOT était déjà sous traitement BB au moment de l’inclusion. La moitié de ces patients a été randomisée dans le groupe contrôle, impliquant dont l’arrêt du traitement. Les auteurs de REBOOT ont procédé à une analyse post-hoc pour évaluer l’effet de l’arrêt du traitement BB chez ces patients. Ils ne retrouvent pas de signal négatif de l’arrêt du traitement, alors même que le traitement chronique est interrompu après un épisode aigu d’IDM. Néanmoins, il s’agit de l’analyse d’un sous-groupe de patients d’une étude initialement neutre ; elle est donc au mieux exploratoire. Néanmoins, deux essais étudiant l’arrêt du traitement BB comparativement à sa poursuite à distance de l’IDM sont encore en cours et apporteront des précisions dans les années qui viennent : SMART-DECISION (NCT04769362) et ABBREVIATE (NCT05081999).
Conclusion et avis personnel
Après randomisation de presque 20.000 patients ayant présenté un IDM avec ou sans sus-décalage du segment ST, pris en charge de manière moderne (revascularisation, statine, double anti-agrégation,…), il n’y a aucun signal de différence de mortalité, de trouble du rythme ventriculaire ou d’épisode d’IC avec ou sans traitement BB. Une des études, à mon sens méthodologiquement plus faible que les autres, suggère une baisse absolue de 1,7% des IDM non fatals, qui n’est pas confirmée par l’analyse poolée. Nul doute qu’une méta-analyse bien conduite, idéalement sur données individuelles, viendra apporter un éclairage supplémentaire. Mon avis, et ma pratique actuelle, est que chez les patients ayant une FEVG supérieure à 50%, ayant bénéficié d’une revascularisation et sans trouble du rythme ventriculaire, il n’y a pas besoin de traitement BB en post-IDM.
De même, l’arrêt du traitement BB chez des patients ayant un antécédent d’IDM revascularisé et une FEVG normale (et non pas normalisée sous traitement !) est tout à fait possible, si l’élévation tensionnelle concomitante est compensée par l’adaptation des doses des autres traitements antihypertenseurs – notamment inhibiteur de l’enzyme de conversion que tout patient en prévention secondaire d’un IDM devrait avoir.
Les patients ayant une altération persistante de la FEVG à la sortie de l’hôpital (et non pas juste à la phase aiguë avant revascularisation quand le myocarde est sidéré) relèvent d’un traitement BB puisque c’est le traitement de base de l’IC à FEVG altérée. Il en est de même des patients ayant présenté un trouble du rythme ventriculaire. Les patients n’ayant pas été revascularisés devraient, je pense, être mis sous BB, parce que cette population n’a pas été incluse dans les essais modernes et se rapproche donc plus des essais de la fin du XXème siècle, sans compter l’interrogation que j’évoquais concernant le lien entre récidive et (non-)revascularisation dans BETAMI-DANBLOCK. On pourra éventuellement discuter à distance l’arrêt du traitement si l’évolution est satisfaisante (absence de trouble du rythme, d’angor ou d’IDM dans les mois précédents).
Deux populations soulèvent à mon sens plus de question. D’une part les patients ayant présenté un épisode congestif à la phase aiguë, sans altération de la FEVG – si la FEVG est inférieure à 40%, l’indication des BB est posée par l’IC à FEVG altérée. La congestion en phase aiguë était un critère d’exclusion de toutes les études depuis CAPITAL, ce qui incite à placer ses patients sous BB en l’absence de démonstration moderne de non-infériorité d’une stratégie sans BB. Cependant, COMMIT a inclus des patients congestifs en phase aiguë, et n’a pas réussi à démontrer de bénéfice du traitement BB malgré une prise en charge de l’IDM moins optimale qu’actuellement…
Reste enfin la question des patients quittant l’hôpital avec une FEVG à 40-50%, revascularisés et n’ayant présenté ni épisode rythmique ventriculaire ni épisode congestif. La réponse dépend je pense de comment cette population est considérée : comme des patients ayant une FEVG inférieure à 50% (donc plutôt « altérée » ou « non-conservée ») ou une FEVG supérieure 40 % (donc plutôt « conservée » ou « non-altérée »).
- Dans le premier cas, compte tenu des résultats présentés dans la méta-analyse publiée dans le Lancet, on peut considérer que ces patients bénéficieraient de la mise en place d’un traitement BB.
- Dans le deuxième cas, on considère qu’il s’agit d’un petit sous-groupe dont l’individualisation par rapport aux patients avec FEVG supérieure à 50% est sujette à caution et chez qui la baisse significative mais faible d’un critère composite sans positivité des critères individuels devient cliniquement discutable. Et comme CAPRICORN n’a pas démontré de bénéfice au traitement BB en cas de FEVG inférieure à 40% en post-IDM immédiat, il y a peu de chance qu’il existe un bénéfice pour une FEVG supérieure à 40% après traitement moderne de l’IDM.
Tout n’est donc pas tranché, comme souvent en médecine. La meilleure façon de prendre une décision étant alors d’en discuter avec les patients.
J’ai utilisé NotebookLLM pour la comparaison des protocoles, critères d’inclusion ou d’exclusion et la recherche de certaines informations précises ; les réponses ont été systématiquement vérifiées. La lecture des publications, la réflexion et la rédaction sont faites sans IA. A l’ancienne.

Merci pour le travail, super intéressant ✊
J’aimeJ’aime